A Regionális Genetikai Laboratóriumban citogenetikai (G-sávozás), molekuláris citogenetikai (fluoreszcens in situ hibridizáció – FISH) és molekuláris genetikai (PCR, szekvenálás, Southern-blot) vizsgálatokat végzünk veleszületett fejlődési rendellenességekben.
Genetikai vizsgálat indikációja veleszületett fejlődési rendellenességekben
- többszörös fejlődési rendellenesség
- arcdysmorphia
- ajak- és szájpadhasadék
- csontrendszeri rendellenességek
- bizonytalan külső nemi szervek, hypogonadismus
- elégtelen szomatikus fejlődés
- lányok növekedési retardációja
- mentális fejlődés zavara
- minor rendellenességek (négyujj-redő, preauricularis fistula vagy függelék, hyper- hypotelorismus)
Vizsgálati minta: perifériás vér
Citogenetikai vizsgálathoz: 2-3 ml teljes vér zöld kupakos (nátrium-heparin alvadásgátlót tartalmazó) csőben. A csövet néhányszor össze kell forgatni, hogy a vér elkeveredjen az alvadásgátlóval. Egyéb alvadságátlót (lítium-heparin, EDTA) tartalmazó cső használata nem javasolt, mert az kedvezőtlenül befolyásolja a sejttenyésztést. A mintát a laboratóriumba érkezésig szobahőmérsékleten kell tartani és 24h-n belül a laboratóriumba juttatni!
FISH vizsgálathoz a kromoszómapreparálás során nyert sejtszuszpenziót használjuk.
Molekuláris genetikai vizsgálatokhoz (DNS preparálás): 5-10 ml teljes vér lila kupakos (EDTA alvadásgátlót tartalmazó) csőben. A mintát a laboratóriumba érkezésig szobahőmérsékleten kell tartani és 24h-n belül a laboratóriumba juttatni!
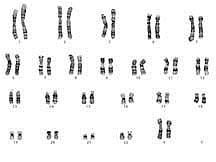
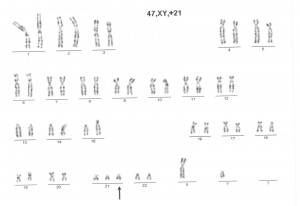
Citogenetikai vizsgálati módszer
 |
 |
||
A vizsgálati mintát 10 ml tápfolyadékot és phytohemagglutinint (PHA) tartalmazó steril tenyésztőedényben 72 órán át tenyésztjük 37°C-on, CO2 termosztátban. A tenyésztés leállítása colchicinnel történik, aminek hatására az osztódásban lévő sejtek metafázisban (a kromoszómák itt vannak a legkondenzáltabb, legkönnyebben vizsgálható formában) felszaporodnak. A metafázisú és interfázisú (nem osztódó) sejtek kipreparálása hipotonizálás és fixálás révén történik. A kromoszómák vizsgálatához a sejtszuszpenzióból mikroszkóp tárgylemezre cseppentünk néhány cseppet, majd a lemez néhány napos érlelése után Giemsa festékkel (G-sáv) festjük a lemezeket/preparátumokat. Minimum 15 metafázist vizsgálunk, ebből 10-et részletesen analizálunk. Mozaicizmus gyanúja esetén 30 metafázis vizsgálatára kerül sor. Valamennyi metafázis képét elektronikus formában rögzítjük.
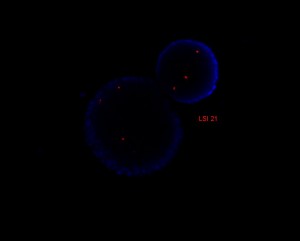
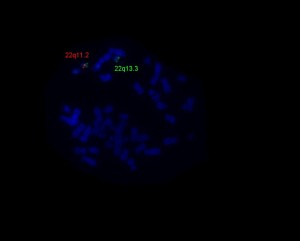
FISH vizsgálat
 |
 |
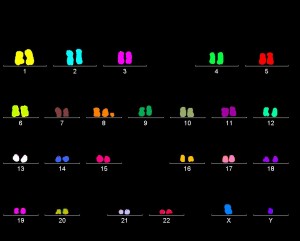 |
Hagyományos kromoszómaanalízis mellett bizonyos esetekben a genetikai eltérések kimutatására FISH vizsgálatokat végzünk. A módszer alkalmas a kromoszómaanalízissel nem látható genetikai eltérések (pl. mikrodeléciók, subtelomerikus kromoszómaátrendeződések) kimutatására, valamint a marker kromoszómák eredetének tisztázására. A FISH analízis során fluorokrómmal jelölt DNS próbát hibridizálunk a vizsgálni kívánt kromoszómarégióhoz, ezek segítségével konkrét számbeli és szerkezeti eltérések mutathatók ki. A módszer nemcsak metafázisú kromoszómákon, hanem interfázisú sejteken is alkalmazható. Nagyszámú sejt (300-500) analízise révén lehetővé válik a mozaikosság arányának pontosabb megadása. Mozaicizmus esetén egyéb szövetek (pl. szájnyálkahártya) is vizsgálhatók.
Southern-blot
FMR1 gén vizsgálata (A vizsgálathoz 5-10 ml EDTA-val alvadásgátolt vér szükséges.)
A Fragilis-X szindróma a leggyakoribb örökletes, mentális retardációval járó kórkép, amelynek becsült incidenciája fiúkban 1:4000-9000, lányokban 1:7000-15000. A betegség jellemző tünetei fiúkban: dysmorphiás tünetek (hosszúkás arc, nagy, elálló fülek), a beszédfejlődés késése, kognitív hiányosságok, mentális retardáció, viselkedési problémák (hiperaktivitás, autisztikus viselkedés, figyelemhiány), macroorchidismus. A lányok szintén érintettek lehetnek. A mutációt hordozó lányok 50-60%-át enyhe vagy közepesen súlyos mentális retardáció jellemzi.
A betegség génje, az FMR1 gén az Xq27.3 régióba lokalizálódik és egy RNS-kötő fehérjét (FMRP) kódol. A betegség hátterében az FMR1 gén 5’UTR részén található CGG trinucleotid repeatek expanziója és az ennek következtében kialakuló hypermetiláció áll. A CGG repeatek száma normális esetben 6-50 közé esik, a leggyakoribb ismétlődési szám 29-30. Ha az ismétlődés szám 59-200 közé esik és az allél nem metilált, akkor premutációról beszélünk. A premutáció nem okoz mentális retardációt, de nőkben korai menopausát, míg férfiakban a kései tremor/ataxia syndroma kialakulását okozhatja. A premutáció instabil, az anyai átörökítés során teljes mutáció (fullmutáció) jöhet létre. Ennek a kockázatát az anyai premutáns tripletszám alapvetően befolyásolja; 100 feletti tripletszám esetén a kockázat >95%. A legkisebb tripletszám, amelyből fullmutáció alakulhat ki 59. A normál és a premutáció közé eső 50-58-as repeatszám tartományt intermedier vagy szürke zónának nevezzük, amely már mutathat némi instabilitást. A betegségokozó teljes vagy fullmutáció esetén a tripletszám 200 fölé emelkedik, amelynek következtében a promoter régió metilálódik és a transzkripció gátlódik. A betegség ritka esetekben a kódoló szekvenciában bekövetkező deléció vagy pontmutáció következtében is kialakulhat.
A meghatározás elve
Az FMR-1 génben bekövetkező tripletexpanzió kimutatására chemiluminescens Southern-blot technikát alkalmazunk. A vizsgálat első lépéseként a betegek perifériás véréből (5-10 ml) DNS-t izolálunk kisózásos módszerrel. Minden beteg esetén a DNS mintát két restrikciós enzimmel emésztünk, amelyek közül az egyik metilációra érzékeny enzim. Ha az FMR-1 allél a mutáció vagy az X-inaktiváció következtében metilált, akkor az enzim nem képes azt hasítani, így nagyobb fragmentum keletkezik. A vizsgálat során, tehát nem csak a triplet expanzió mértékét, hanem az FMR-1 allél metiláltságát is tudjuk vizsgálni.
Az emésztett DNS fragmentumokat agaróz gélen választjuk el egymástól, majd a fragmentumokat denaturálást és neutralizálást követően nylon membránra blottoljuk át. A hibridizáció során az FMR-1 gén kimutatására a digoxigeninnel jelölt pFxa1NHE próbát használjuk, amely nem a CGG repeat regióhoz, hanem attól 3’ irányban (13830nt-16342nt) kötődik az FMR-1 génhez. Az FMR-1allél detektálása chemiluminescens technikával történik, amelynek során foszfatázhoz kapcsolt anti-digoxigenin antitestet, majd CSPD szubsztrátot adunk a memránhoz. A CSPD szubsztrát bomlása során chemiluminescens fény keletkezik, amelyet röntgen filmen detektálunk. A filmen látható sávok elhelyezkedéséből, méretéből következtetünk a tripletexpanzió (pre- vagy fullmutáció) mértékére, illetve az allélok metiláltságára.
PCR alapú vizsgálatok (A vizsgálathoz 5-10 ml EDTA-val alvadásgátolt vér szükséges.)
Achondroplasiára specifikus c.1138G>A és c.1138G>C mutáció kimutatása
Hypochondroplasia specifikus c.C1620A és c.C1620G mutáció kimutatása
Cranyosynostosisokban végzett mutációs vizsgálatok
– TWIST transzkripciós faktor génjében (7p21.2) bekövetkező mutációk patogén szereppel bírnak a Saethre –Chotzen szindróma kialakulásában
– FGFR2 gén mutációi (p.S252W, p.P253R) Apert szindrómában
– FGFR2 gén 8-as (IIIa) és 10-es (IIIc) exonjának mutáció analízise Crouzon, Pfeiffer, Jackson-Weiss, Beare Stevenson szindrómákban
